Généralités sur les tests de résistance
Il existe trois grandes catégories de tests qui permettent de mettre en évidence des résistances aux PPP:
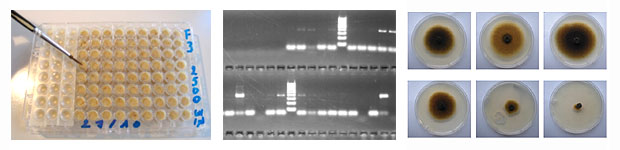
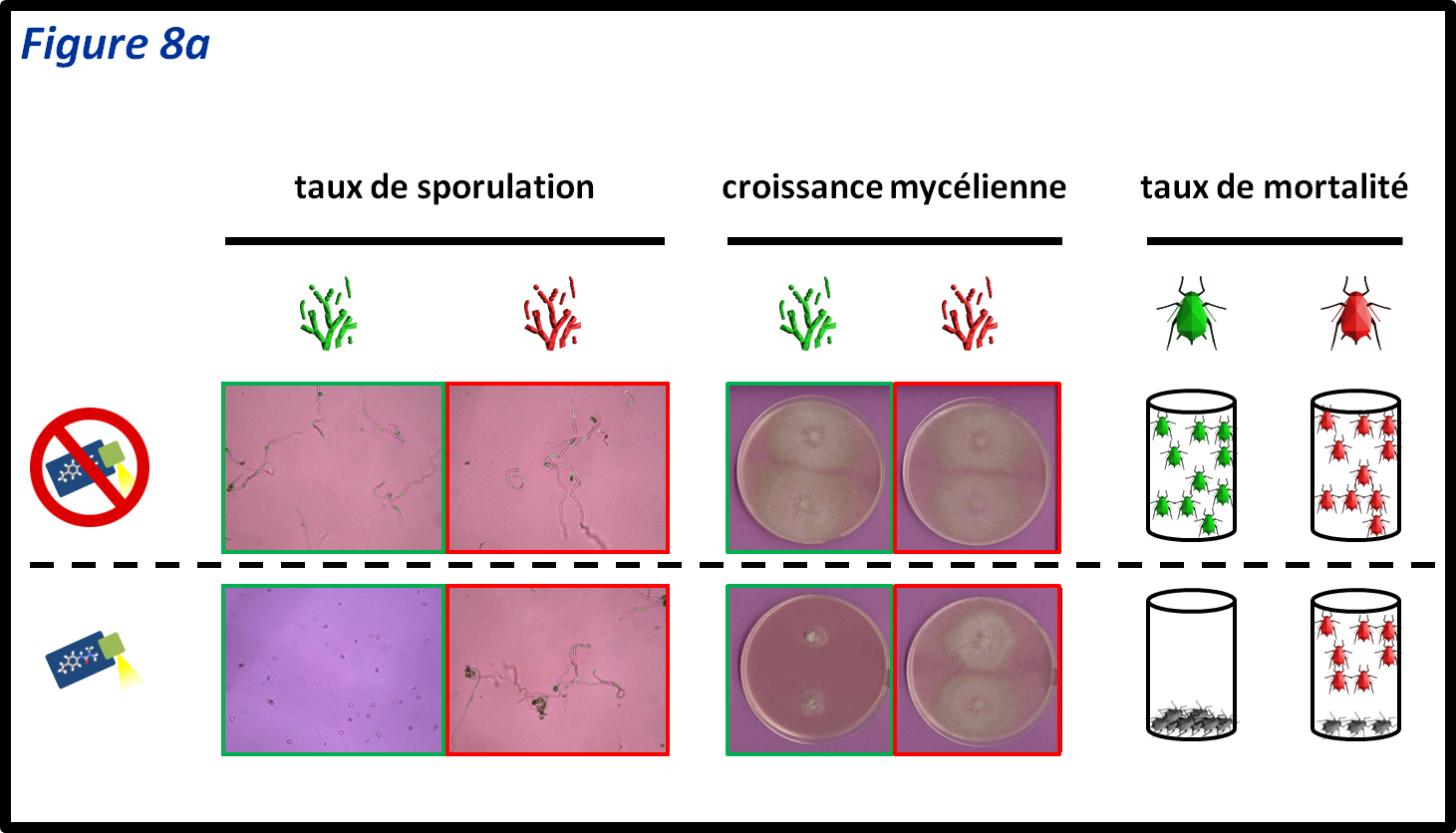
- les tests biologiques mesurent la réaction de bio-agresseurs vivants en réponse à des PPP. Ils mettent en évidence la résistance quel(s) que soi(en)t le ou les mécanisme(s) sous-jacent(s). Ils ne nécessitent pas de connaitre la nature des mécanismes de résistance impliqués car ils mesurent un phénotype de résistance. Ce phénotype est la résultante de l’ensemble des mécanismes qui sont impliqués dans la résistance, que ceux-ci soient identifiés ou non, liés ou non à la cible, unique ou en combinaison ;
- les tests biochimiques consistent à doser les activités enzymatiques des grandes familles d’enzymes impliquées dans la détoxication (RNLC). Contrairement aux tests biologiques, ils ne détectent pas toutes les résistances. Cependant, ces tests présentent l’avantage d’être réalisés sur des extraits protéiques qui sont plus facile à garder au laboratoire que des organismes vivants ;
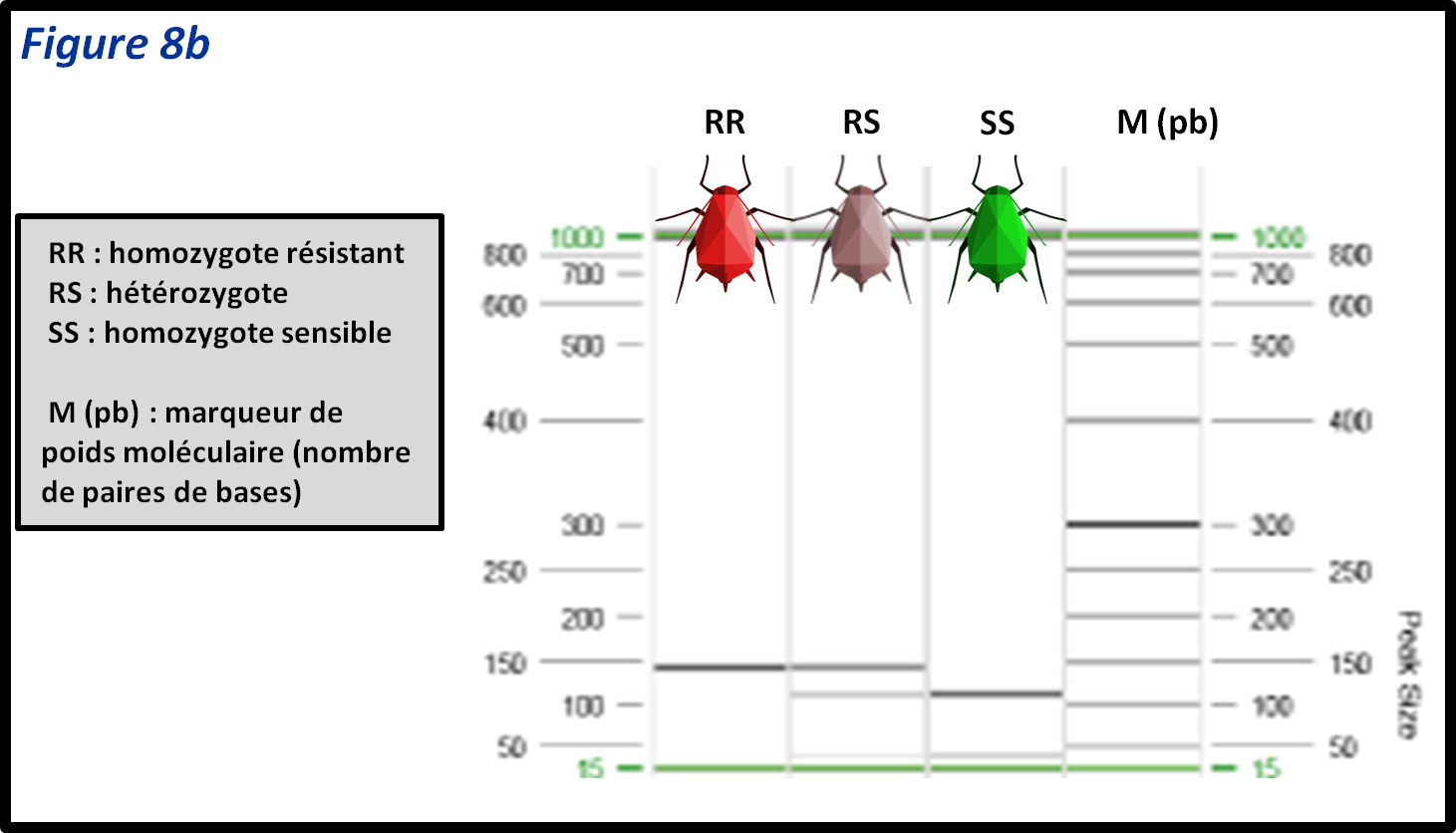
- les tests de biologie moléculaire reposent sur la détection des variations de séquence codante ou de l’expression de gènes impliqués dans les phénomènes de résistances. Ces tests permettent de travailler sur du matériel biologique même mort ou en mauvais état, et requièrent la plupart du temps très peu de matériel de départ. C’est également le type de test qui est le plus facilement automatisable et adaptable au très haut débit.
Tests récents et futurs
Les développements technologiques permettent une miniaturisation des tests plus poussée, une automatisation plus grande, et de ce fait une augmentation du nombre d’échantillons qu’il est possible d’analyser.
- Dans le domaine des tests biologiques, voire des tests biochimiques, l’analyse d’image pourra probablement améliorer la fiabilité et l’automatisation de la notation des traits de vie des bio-agresseurs exposés aux PPP.
- Dans le domaine de la biologie moléculaire, de nombreuses nouvelles méthodes adaptées au « haut–débit », voire au « très haut–débit » sont déjà disponibles. Les approches de génotypage de mutations par séquençage « haut-débit » sont particulièrement intéressantes, et ont commencé à être utilisées pour le diagnostic de RLC. Ces méthodes permettent non seulement de rechercher des mutations connues et d’estimer les fréquences des différents allèles dans des populations de bio-agresseurs, mais aussi potentiellement de détecter de nouveaux variants.